Leitfaden der Elektrochemie PDF
Preview Leitfaden der Elektrochemie
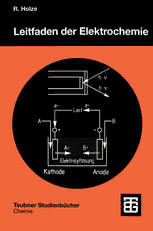
Teubner StudienbOcher Chemie R. Holze Leitfaden der Elektrochemie Teubner Studienbi.icher Chemie Herausgegeben von Prof. Dr. rer. nat. Christoph Eischenbroich, Marburg Prof. Dr. rer. nat. Friedrich Hensel, Marburg Prof. Dr. phil. Henning Hopf, Braunschweig Die Studienbucher der Reihe Chemie sollen in Form einzel ner Bausteine grundlegende und weiterfuhrende Themen aus allen Gebieten der Chemie umfassen. Sie streben nicht die Breite eines Lehrbuchs oder einer umfangreichen Mo nographie an, sondern soli en den Studenten der Chemie - aber auch den bereits im Berufsleben stehenden Chemiker - kompetent in aktuelle und sich in rascher Entwicklung be findende Gebiete der Chemie einfUhren. Die Bucher sind zum Gebrauch neben der Vorlesung, aber auch - da sie hc1ufig auf Vorlesungsmanuskripten beruhen - anstelle von Vorlesungen geeignet. Es wird angestrebt, im Laufe der Zeit aile Bereiche der Chemie in derartigen Lehrbuchern vorzu stellen. Die Reihe richtet sich auch an Studenten anderer Naturwissenschaften, die an einer exemplarischen Darstel lung der Chemie interessiert sind. Leitfaden der Elektrochemie Von Prof. Dr. rer. nat. Rudolf Holze Technische Universitat Chemnitz m B. G. Teubner Stuttgart· Leipzig 1998 Prof. Dr. rer. nat. Rudolf Holze Geboren 1954 In Hildesheim/Niedersachsen. Von 1973 bis 1979 Stu dium der Chemie an der Universitat Bonn, Diplomarbeit Ober "Neue Kathodenmaterialien fOr Lithiumbatterien" und 1983 Promotion mit dem Thema "Impedanzmessungen an porosen Elektroden" bei Prof. Viel stich, Bonn. Von 1983 bis 1984 Postdoctoral Fellow am Case Center for Electrochemical Sciences der Case Western Reserve University in Cleveland/USA bei Prof. E. Yeager als Stipendiat der Heinrich-Hertz Stiftung. Von 1984 bis 1987 wiss. Assistent am Institut fOr Physikalische Chemie der Universitat Bonn. 1987 Hochschulassistent, 1989 Habilita tion fOr das Fach "Physikalische Chemie" und 1991 Hochschuldozent im Fachbereich Chemie der Universitat Oldenburg. Seit 1993 Professor fOr Physikalische Chemie/Elektrochemie an der Technischen Universitat Chemnitz. Die Deutsche Bibliothek - CIP-Einheitsaufnahme Holze, Rudolf: Leitfaden der Elektrochemie / von Rudolf Holze. - Stuttgart; Leipzig : Teubner, 1998 (Teubner-StudienbOcher: Chemie) ISBN-13: 978-3-519-03547-3 e-ISBN-13: 978-3-322-80122-7 DOl: 10.1007/978-3-322-80122-7 Das Werk einschlieB1ich alier seiner Teile ist urheberrechtlich geschOtzt. Jede Verwertung auBerhalb derengen Grenzen des Urheberrechtsgesetzes ist ohne Zustimmung des Veri ages unzulassig und strafbar. Das gilt besonders fOr Vervielfaltigungen, Obersetzungen, Mikroverfilmungen und die Einspeiche rung und Verarbeitung in elektronischen Systemen. © 1998 B. G. Teubner Stuttgart· Leipzig Vorwort Elektrochemie ist eine auBerordentlich interdisziplinare Wissenschaft im Be riihrungsfeld von Chemie, Physik, Werkstoffwissenschaft, Biologie und zahlrei chen anderen technisch-naturwissenschaftlichen Disziplinen. In beispielhafter Weise vereinigen sich grundlagenorientierte und anwendungsbezogene Aspekte. Kaum eine elektrochemische experimentelle Arbeit ist ohne einen zumindest mittelbaren Bezug zu einem praktischen Verfahren. Die Anwendungen reichen von in groBem Umfang eingesetzten elektrochemischen Produktionsverfahren iiber die aus der technischen Welt nicht mehr wegzudenkenden elektrochemi schen Energiespeicher bis zur Ultraspurenanalytik und Sensorik. Diese groBe und allgemeine Bedeutung rechtfertigt eine angemessene Darstellung im Chemie studium. Elektrochemie wird daher im Studium bereits in den ersten Semestern in Vor lesungen der organischen, anorganischen und physikalischen Chemie angespro chen. Die vielseitigen Wege der Annaherung und unterschiedlichen Wichtungen von Grundlagen, Methoden oder Anwendungen lassen ordnende Konzepte und gemeinsame Grundlagen nicht immer mit der notigen Klarheit erkennen. Diese Liicke wird mit dies em kompakten Leitfaden geschlossen. Anders als umfassen de Lehrbiicher der physikalische Chemie, die zahlreiche Aspekte der Elektro chemie mit unterschiedlicher Intensitat behandeln, wird hier ein Uberblick gegeben, der Grundlegendes und Typisches hervorhebt. Dabei geht der Bezug zu den zahlreichen Feldern der Anwendung elektrochemischer Konzepte und Methoden deutIich hervor. Dies fiihrt zu einem tieferen Verstandnis der E1ektro chemie und erleichtert den Zugang zu intensiver Beschaftigung mit ihr. Daher wird in diesem Leitfaden immer wieder anschlieBend an die Darstellung der Grundlagen, Theorien und Modelle die Anwendung beschrieben. Auch dies ist ein wichtiger, das tiefere Verstandnis erleichternder Unterschied zu umfassen den Lehrbiichern. Diese unmittelbare Verkniipfung erlaubt die rasche Uberprii fung des zuvor erworbenen theoretischen Wissens an praktischen Fragestellun gen. Dabei konnen im begrenzten Umfang eines Leitfadens natiirlich nicht aile theoretischen wie praktischen Aspekte vollstandig und mit gleicher Intensitat behandeIt werden. Trotzdem ist der Uberblick so vollstandig, daB von diesem Buch ausgehend der Zugang zu allen Feldern der Elektrochemie erfolgverspre chend moglich ist. Die bestehende Liicke zwischen allgemeinen Lehrbiichern einerseits und der Fachliteratur andererseits solI so geschlossen werden. Das vorliegende Buch ist aus einer Vorlesung hervorgegangen, in der Studieren de im Grundstudium der Chemie einen Uberblick iiber die wichtigsten Aspekte 6 Vorwort der Elektrochemie erhalten sollen. Dabei stehen die Vollstandigkeit und die Er schlieBung des Arbeitsgebietes im V ordergrund, manche Details der Grundlagen wie der experimentellen Methoden und technischen Anwendungen konnen im knappen Umfang nicht uberall beriicksichtigt werden. Die naheliegende Idee, am Ende der Kapitel Hinweise aufLehrbucher, Monographien und Ubersichtsar tikel zu geben, die einen weitergehenden Einblick erlauben, muBte recht rasch verworfen werden. Da sich das Buch an einen sehr heterogenen Leserkreis richt et, ist es schlicht unmoglich, solche Hinweise in auch nur annahemd allgemein gultiger und fur jeden Leser und jede Leserin in gleich guter Weise und verwert barer Form zu geben. Die in Zukunft eher noch knapper werdenden Biblio theksmittel lassen hier kaum Besserung erhoffen. Andererseits ist es in praktisch jeder Bibliothek moglich, mit Hilfe "elektronischer Kataloge" einen raschen Zu gang zu den vorhandenen Buchem und Zeitschriften zu gewinnen. Hiermit durfte das Auffinden weiterfuhrender Literatur auch in sehr speziellen Fallen keine Schwierigkeit bereiten. Zum Einstieg in eine solche Literatursuche sind am Ende jedes Kapitels Stich- und Schlagworte genannt, die entsprechend einschlagigen Systematiken zuverlassig zum Erfolg fuhren. Diesem Zweck dient auch das umfangreiche Register, das in vielen Fallen nicht nur das rasche Auf finden wichtiger Definitionen, Gesetze und gangiger Begriffe erlaubt, sondem auch die Verbindung zu entsprechenden experimentellen Techniken und prakti schen Anwendungen herstellt. Fur den an umfassenden Lehrbuchem zum Ge samtgebiet der Elektrochemie wie zu wichtigen Teilgebieten Interessierten gibt folgende Ubersicht einige Anregungen: J.O'M. Bockris und A.K.N. Reddy, Modern Electrochemistry, Plenum Press, 1972 J. Koryta, Lehrbuch der Elektrochemie, Springer Verlag, 1976 C.H. Hamann und W. Vielstich, Elektrochemie, VCH-Wiley Verlag, 1998 E. Zimgiebl, Einfohrung in die Angewandte Elektrochemie, Salle Verlag, 1993 W. Schmickler, Grundlagen der Elektrochemie, Vieweg Verlag, 1996 D. T. Sawyer, Electrochemistry for Chemists, John Wiley & Sons, 1995 Organic Electrochemistry: An Introduction and a Guide, H. Lund und M.M. Baizer Hrsg., Marcel Dekker, 1991 Symbole und Achsenbeschriftungen sind nach den Empfehlungen der IUP AC (Pure Appl. Chern. 37 (1974) 499) ausgefuhrt. Dies wird im Vergleich zu ande ren, vor aHem alteren Lehrbiichem, moglicherweise zu Verwirrung ftihren. Das ausfuhrliche Symbolverzeichnis (S. 299) soli hier weiterhelfen. Dimensionen sind dabei durch einen Schragstrich von der zugehOrigen Zahl getrennt, nur in Ausnahmen wird der besseren Ubersicht halber die Dimension in eckigen Klammem angegeben. Das Buch ware ohne die Hilfe zahlreicher Mitarbeiter und Freunde nicht entstanden. Fur experimentelle Daten und praktische Hinwei se auf Details danke ich V. Brandl, M. Bron, S. Kania, J.Lippe, W. Leyffer, K. Oehlschlager, M. Probstund P. Roland. Inhalt Eine Einfiihrung: Zwei Metallbleche, eine L6sung und eine Stromquelle .................................................................................... 9 2 Elektrochemie im Gleichgewicht: lonen und Elektroden ....................... 14 2.1 Aktivitaten von lonen in Lasung, das elektrochemische Potential .......... 14 2.2 Die Debye-Huckel-Theorie ................................................................... 23 2.3 Potentiale und Strukturen an Phasengrenzen: Nemst-Gleichung und Doppelschicht ................................................... 33 2.4 Elektroden ........................................................................................... 50 2.5 Elektrochemische Analytik: Ionenselektive Elektroden ........................ 57 2.6 Einfache Anwendungen: Potentiometrie, Aktivitatsbestimmungen ...................................................................... 67 2.7 Elektrochemische Zellen ...................................................................... 76 2.8 Elektrochemie und Thermodynamik, die Spannungsreihe ..................... 86 2.9 Elektrochemische Energiespeicher: Batterien, Akkum ulatoren und Brennstoffzellen ................................................. .1 00 3 Stoffiransport und elektrochemische Kinetik ...................................... .126 3.1 lonenwanderung im elektrischen F eld und elektrolytische Leitfahigkeit ....................................................................................... 128 3.2 Eine Anwendung: Konduktometrie .................................................... .144 3.3 Stoffbilanzen elektrochemischer Prozesse ........................................... 151 3.4 Struktur und Dynamik elektrochemischer Phasengrenzen .................... 153 3.4.1 Teilschritte elektrochemischer Prozesse: die Uberspannungen ............ .153 3.4.2 Der Ladungsdurchtritt: die Butler-Volmer-Gleichung und die Durchtrittsuberspannung ............................................................... 15 8 3.4.3 Die Konzentrationsiiberspannung ........................................................1 69 3.4.4 Die Adsorptionsiiberspannung ............................................................ 174 3.4.5 Die Kristallisationsuberspannung ........................................................ 178 3.4.6 Elektrokatalyse ................................................................................... 183 3.5 Korrosion ........................................................................................... 185 3.6 Technische Elektrochemie .................................................................. 202 3.7 Elektrochemische Analytik ................................................................. 217 8 Inhalt 4 Methoden der experimentellen Elektrochemie .................................... 224 4.1 Stationiire Methoden: Messung bei konstantem Potential oder Strom ......................................................................................... 228 4.2 Quasistationiire Methoden .................................................................. 239 4.3 Instationiire Methoden ........................................................................ 264 4.4 Nichtklassische Methoden: Oberfliichenanalytik, Spektroskopie .................................................................................... .274 Liste der Symbole und Abkiirzungen .................................................. 299 Register ............................................................................................. 307 1 Eine Einfiihrung: Zwei Metallbleche, eine Losung und eine Stromquelle Elektrochemie ist als ein an zahlreiche naturwissenschaftliche Arbeitsgebiet (Chemie, Physik, Biologie, Materialkunde, Medizin) angrenzendes, sehr inter disziplinares Arbeitsgebiet schwer mit einer knappen Definition zu beschreiben. In der klassischen Darstellung der Elektrochemie als der Lehre von der Bezie hung zwischen elektrischen und chemischen Prozessen oder der Vorstellung als physikalischer Chemie unter Beteiligung geladener Teilchen (Ionen) werden die vielseitigen Aspekte, die tiber das Auftreten und die besonderen Eigenschaften von lonen hinausgehen, nicht deutlich. Bezeichnet man Elektrochemie als die Wissenschaft von Elektronentibertragungsreaktionen vor allem an Phasengren zen (FestkorperlFltissigkeit, Membran, Zellwand, FestkorperlFestkorper, nicht mischbare Fltissigkeit), so kommt man der groBen Vielseitigkeit dieses Gebietes naher. Anschaulicher ist dagegen die Betrachtung der Resultate einer Reihe einfacher Experimente, die mit elektrochemischen Phanomenen, Methoden und Modellen vertraut machen. Ais experimentelle Anordnung wird ein GlasgefaB mit einer wiillrigen Losung eines Salzes oder einer Saure verwandt, in das zwei Metallbleche eintauchen. Bild 1.1 MeBanordnung fiir einfache elektrochemische Versuche. Sie sind entsprechend Bild 1.1 mit einer auBeren einstellbaren Spannungsquelle (Batterie) verbunden. Die an den Blechen anliegende elektrische Spannung und 10 1 Einflihrung der flieBende Strom werden mit Volt-und Milliamperemeter gemessen. Werden zwei Platinbleche und als Fliissigkeit reinstes Wasser verwendet, so registriert man bei einer angelegten Spannung von ca. 1 - 2 Volt einen auBerst geringen Strom, der kurze Zeit nach dem Einschalten praktisch verschwindet. Da im Wasser freie Elektronen nur eine auBerst geringe Lebensdauer haben, muB der StromfluB auf anderen beweglichen Ladungstragern beruhen. Nach der Eigendissoziation des Wassers gemiiB (1.1) ist eine sehr kleine Konzentration von Protonen und Hydroxidionen (in jeweils hydratisierter Form) vorhanden, die den Strom transportiert. Wenn in der Fliissigkeit Salzsaure gelost ist, so beobachtet man einen wesentlich groBeren Strom als im ersten Experiment. Die Leitfahigkeit einer Losung hangt offenbar von der Konzentration der darin gelosten lonen abo Bei Salzsaure kann angenommen werden, daB sie als starke Saure voI1ig in lonen dissoziiert ist. Man bezeichnet allgemein Stoffe, die in geladene Tei1chen (Ionen) zerfallen (dissoziieren) konnen (z.B. Salz- oder Essigsaure) oder die bereits im festen Zustand in lonenform vorliegen (Natriumchlorid), als Elektrolyte. Sprachlich etwas ungenau werden Losungen so1cher Elektrolyte in einem Losungsmittel ebenfalls oft als Elektrolyte und nicht priiziser als Elektrolytlosung bezeichnet. Uber die erhOhte Leitfahigkeit hinaus beobachten wir an den beiden Platinble chen weitere Veranderungen. Dies steht im Gegensatz zur Erfahrung, daB ein metallischer elektrischer Leiter sich unter Strom fluB, abgesehen von einer gerin gen Erwarmung bei groBeren Stromstiirken, nicht verandert. An beiden BIechen, die wir als Elektroden bezeichnen wollen, wird eine Gasentwicklung beobachtet, deren Intensitat mit gesteigerter Stromstiirke zunimmt. An der mit dem Pluspol der auBeren Stromquelle verbundenen Elektrode ist Chlorgeruch wahrnehmbar; das an der anderen Elektrode entwickelte Gas kann mit der Knallgasprobe als Wasserstoff identifiziert werden. Wahrend an der ersten Elektrode (am Pluspol) eine Oxidation gemiiB (1.2) ablaufi (diese Elektrode wird Anode genannt), bildet sich an der anderen Elektrode in einer Reduktion Wasserstoffnach (1.3) die Elektrode heiBt Kathode. Der Begriff "Elektrode" wie auch die Bezeichnun gen der beiden Elektroden als "Anode" und "Kathode" gehen auf Michael Fara day zurUck. Die Zellreaktion, mit der der Elektrochemiker das gesamte Gesche-
