III.Allgemeiner Teil III.2.5. Umsatzbestimmung der enzymatischen Synthese von Glutaryl-7-ACA ... PDF
Preview III.Allgemeiner Teil III.2.5. Umsatzbestimmung der enzymatischen Synthese von Glutaryl-7-ACA ...
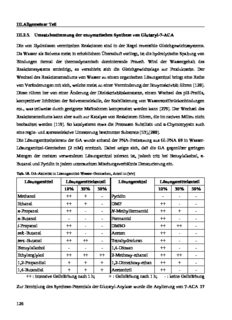
III.Allgemeiner Teil III.2.5. Umsatzbestimmung der enzymatischen Synthese von Glutaryl-7-ACA Die von Hydrolasen vermittelten Reaktionen sind in der Regel reversible Gleichgewichtssysteme. Da Wasser als Solvens meist in erheblichem Überschuß vorliegt, ist die hydrolytische Spaltung von Bindungen formal der thermodynamisch dominierende Prozeß. Wird der Wassergehalt des Reaktionssystems erniedrigt, so verschiebt sich die Gleichgewichtslage zur Produktseite. Der Wechsel des Reaktionsmediums von Wasser zu einem organischen Lösungsmittel bringt eine Reihe von Veränderungen mit sich, welche meist zu einer Verminderung der Enzymaktivität führen [120]. Diese rühren her von einer Änderung der Dielektrizitätskonstante, einem Wechsel des pH-Profils, kompetitiver Inhibition der Solvensmoleküle, der Stabilisierung von Wasserstoffbrückenbindungen etc., was teilweise durch geeignete Maßnahmen kompensiert werden kann [279]. Der Wechsel des Reaktionsmediums kann aber auch zur Katalyse von Reaktionen führen, die im nativen Milieu nicht beobachtet werden [119]. So katalysieren etwa die Proteasen Subtilisin und α-Chymotrypsin auch eine regio- und stereoselektive Umesterung bestimmter Substrate [53],[280]. Die Lösungsmitteltoleranz der GA wurde anhand der PNA-Freisetzung aus Gl-PNA 69 in Wasser- Lösungsmittel-Gemischen (2 mM) ermittelt. Dabei zeigte sich, daß die GA gegenüber geringen Mengen der meisten verwendeten Lösungsmittel tolerant ist, jedoch tritt bei Benzylalkohol, n- Butanol und Pyridin in jedem untersuchten Mischungsverhältnis Denaturierung ein. Tab. 50. GA-Aktivität in Lösungsmittel-Wasser-Gemischen, Anteil in (v/v) Lösungsmittel Lösungsmittelanteil Lösungsmittel Lösungsmittelanteil 10% 30% 50% 10% 30% 50% Methanol ++ + - Pyridin - - - Ethanol ++ + - DMF ++ - - n-Propanol ++ - - N-Methylformamid ++ + - n-Butanol - - - Formamid ++ - - i-Propanol ++ - - DMSO ++ ++ - sek.-Butanol ++ - - Aceton ++ - - tert.-Butanol ++ ++ - Tetrahydrofuran ++ - - Benzylalkohol - - - 1,4-Dioxan ++ - - Ethylenglykol ++ ++ ++ 2-Methoxy-ethanol ++ ++ - 1,2-Propandiol + + + 1,2-Dimethoxy-ethan ++ + - 1,4-Butandiol + + + Acetonitril ++ - - ++ : intensive Gelbfärbung nach 1 h; + : Gelbfärbung nach 1 h; - : keine Gelbfärbung Zur Ermittlung des Synthese-Potentials der Glutaryl-Acylase wurde die Acylierung von 7-ACA 17 126 III.Allgemeiner Teil mit verschiedenen Enzympräparationen, Acyldonoren und in unterschiedlichen Reaktionsmedien untersucht. O O H2N S O O GA HO NH S + N OAc RO X O N OAc CO2H O 17 18 CO2H Abb. 123. Enzymatische Synthese von Gl-7-ACA Während Lipasen und Proteasen in freier Form in organischen Lösungsmitteln aktiv sind [53], wird die freie PGA durch diese desaktiviert. In immobilisierter Form, als quervernetzte Enzymaggregate [59] oder als Lyophilisat in Salzen [281] ist sie jedoch auch in organischen Medien aktiv. Durch die strukturelle Verwandtschaft von PGA und GA war für Letztere ein ähnliches Verhalten zu erwarten. Studien zur Enzymstabilität unter Prozeßbedingungen zeigen, daß bei pH 7.8 die Halbwertszeit der PGA mit 108 s (~ 3 Jahre) um zwei Größenordnungen höher liegt als bei der GA mit 106 s. Während für die GA dieser Wert beim Übergang zu pH 9.0 nur geringfügig abfällt, weist die PGA nur noch eine Halbwertszeit von 104 s (< 1 Tag) auf [282],[283]. III.2.5.1. Synthesepotential in organischen Lösungsmitteln Die Untersuchung des Synthesepotentials der GA in organischen Lösungsmitteln wurde exemplarisch mit DMSO, DMF, Pyridin, Toluol, 1,4-Butandiol, Formamid und Methylformamid als Reaktionsmedium untersucht, da diese bereits in Protease- und PGA-katalysierten Acylierungen erfolgreich verwendet wurden [53],[57]. Als Acyldonoren wurden Glutarsäuremonomethylester (312), Glutarsäure-2,2,2-trifluorethylester (313), Glutarsäuremonoamid (264) und Glutarsäuredimethylester (388) getestet. O O O O F HO OMe HO O 312 313 F F O O O O HO NH MeO OMe 2 264 388 Abb. 124. Verwendete Acyldonoren Trifluorethanol als Abgangsgruppe hat sich aufgrund seiner hohen Flüchtigkeit und der dadurch bedingten irreversiblen Gleichgewichtsverschiebung in enzymatischen Acylierungen bewährt [284]. Die GA wurde in Natriumphosphatpuffer bei pH 8.0 gelöst und lyophilisiert, um den Ionisationsstatus am pH-Optimum zu erhalten [281]. Als Referenz wurde die gleiche Menge 127 III.Allgemeiner Teil Albumin aus Rinderserum ebenfalls in Puffer gelöst und lyophilisiert. Die Proteinlyophilisate und 7-ACA 17 wurden in den jeweiligen Solventien aufgenommen und mit vier Äquivalenten (bezogen auf 7-ACA) Glutarsäuremonomethylester (312) bzw. Glutarsäure- 2,2,2-trifluorethylester (313) bei Raumtemperatur inkubiert. Der Reaktionsfortschritt wurde dünnschichtchromatographisch verfolgt. Für DMSO, DMF, Pyridin, Formamid und Methylformamid zeigte sich, daß die Acylierung von 7- ACA mit beiden Acyldonoren sowohl in den GA- als auch in den Referenzproben in vergleichbarem Maße erfolgte, während in Toluol und 1,4-Butandiol keinerlei Acyltransfer zu detektieren war. Um die Möglichkeit eines basisch katalysierten Acyltransfers zu minimieren, wurde das Experiment mit bei pH 7.0 lyophilisierten Proteinen wiederholt. Auch hier zeigte sich die unselektive Acylierung von 7-ACA 17 in GA- und Referenzproben. Die Verwendung von Glutarsäuremonoamid 264 als Acyldonor mit bei pH 8.0 lyophilisierten Proteinen und einem proteinfreien Lyophilisat resultierte ebenfalls nicht in einer selektiven Transaminierung durch die GA. So bleibt zu vermuten, daß der Acyltransfer in den stark polaren Lösungsmitteln durch die hohe Salzkonzentration an basischen Phosphationen katalysiert wurde. Zur Eliminierung des Phosphat-Einflusses wurde auf eine kommerziell verfügbare immobilisierte GA-Präparation zurückgegriffen, bei der als Trägermaterial Eupergit C dient, ein Kopolymer verschiedener Meth- und Acrylamide. Die immobilisierte GA wurde zunächst mit dem jeweiligen Lösungsmittel äquilibriert und dann zu einer Mischung von 7-ACA 17 (1 Äq.) und Glutarsäuremonoamid 264 (4 Äq.) im entsprechenden Lösungsmittel dazu gegeben. Als Referenz dienten mit reinem Rinderalbumin versetzte Proben. Der Reaktionsfortschritt bei 30°C wurde mittels HPLC verfolgt. In den Ansätzen mit Toluol, Pyridin und 1,4-Butandiol als Reaktionsmedium sowie allen Negativkontrollen konnte keinerlei Syntheseprodukt Gl-7-ACA nachgewiesen werden. Für die übrigen Reaktionsmedien ist der ermittelte Umsatzverlauf im Folgenden graphisch dargestellt. 128 III.Allgemeiner Teil 30 %] 25 A [ Formamid C A 20 Methylformaid 7- DMF Gl- DMSO s 15 e ert si eti 10 h nt y S 5 0 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 Zeit [h] Abb. 125. Verlauf der enzymatischen Acylierung von 7-ACA Während für DMSO und DMF nur eine geringe Syntheseleistung detektiert wurde, die insgesamt 3% Umsatz nicht übersteigt, so konnte für die Umsetzungen in Formamid und Methylformamid eine signifikante Menge synthetisierte Gl-7-ACA 18 nachgewiesen werden. Dieser Befund korreliert mit der Fähigkeit des jeweiligen Lösungsmittels, Wasserstoffbrückenbindungen ausbilden zu können. Dies resultiert in einer höheren Flexibilität und damit Aktivität der GA [120]. Die Untersuchung der Syntheseleistung der GA bei der Verwendung von Glutarsäuredimethylester 388 als Acyldonor erfolgte ohne den Zusatz von weiteren Lösungsmitteln. Der Acyldonor ist zugleich Reaktionsmedium und steht damit nominal im zwanzigfachen Überschuß der Acylierungsreaktion zur Verfügung. Tatsächlich fungiert jedoch nicht Glutarsäuredimethylester selbst als Donor, sondern der geringe Anteil an Glutarsäuremonomethylester (312), der durch unselektive chemische Hydrolyse freigesetzt wird. Die GA wurde jeweils in immobilisierter Form und als Lyophilisat (pH 8.0) der Suspension von 7-ACA 17 in Glutarsäuredimethylester (388) zugesetzt. Als Referenzen dienten wiederum entsprechende Albuminpräparationen. Nach 29 Stunden bei Raumtemperatur enthielten die Reaktionsmischungen 4.6% und 1.2% Gl-7-ACA 18, während in den Referenzproben keine Produktbildung beobachtet werden konnte. Dieser Befund deckt sich mit den Beobachtungen von Biffi [lit. Gardossi], die in Glutarsäuredimethylester (388) als Reaktionsmedium die Acylierung von -Aminosäureestern durch die immobilisierte GA von L Recordati fanden. Zugleiche zeigt sich auch, daß die GA durch Lyophilisation in Puffern keine vollständige Desaktivierung erfährt. 129 III.Allgemeiner Teil III.2.5.2. Synthesepotential in wäßrigen Reaktionsmedien Die Umkehr der enzymatischen Hydrolyse, d.h. Die kinetisch kontrollierte Synthese in wäßrigen Medien, ist Thema zahlreicher enzymologischer Studien. In ihrem natürlichen Umgebungsmedium entfalten Biokatalysatoren ihre höchste Aktivität und es bedarf keiner zusätzlichen Vorkehrungen, diese zu erhalten. Seit der Entdeckung der enzymatischen Acylierung von 6-APA [285] war speziell die Synthese von Antibiotika in wäßrigen Medien Gegenstand umfangreicher Forschungsbemühungen, die schließlich in der erfolgreichen Kommerzialisierung biotechnologischer Prozesse mündeten. Im Rahmen von kontinuierlichen Bemühungen zur industriellen Prozeßoptimierungen werden diese weiterhin betrieben [286],[287]. Da die direkte Kondensation von Säure und Amin thermodynamisch äußerst ungünstig ist, erfolgt die Synthese der Amidbindung durch Acyltransfer mit aktivierten Acyldonoren. Dieser Prozeß wird von kinetischen und thermodynamischen Faktoren bestimmt. Wasser als Reaktionsmedium konkurriert mit dem zu acylierenden Nucleophil um den Acyldonor und das acylierte Nucleophil wird wiederum selbst hydrolysiert. So erfolgt die Produktakkumulation bis zu einem vom Reaktionssystem bestimmten Maximalwert, um danach durch Produkthydrolyse wieder abzufallen [288]. Durch eine Reihe von Maßnahmen kann die Produktanreicherung aber nahezu quantitativ erfolgen und die konkurrierende Hydrolyse weitestgehend unterbunden werden [286]. Die Untersuchung des Synthesepotentials der GA in wäßrigem Medium erfolgte durch Inkubation von 7-ACA 17 mit unterschiedlichen Mengen an Glutarsäuremonoamid (264) als Acyldonor bei pH 8.0 und Raumtemperatur. Die ermittelten Umsatzwerte sind im Folgenden graphisch wiedergegeben. 25 20 %] A [ C A 15 7- Gl- s e ert 10 si eti h 7.9 Äq. Gl-Monoamid ynt 5 13.2 Äq. Gl-Monoamid S 2.5 Äq. Gl-Monoamid 0 0 10 20 30 40 50 60 70 80 90 100 110 120 180 Zeit [min] Abb. 126. Gl-7-ACA Synthese in Wasser 130 III.Allgemeiner Teil Bei der Umsetzung mit 2.5 und 7.9 Äquivalenten Glutarsäuremonoamid (264) erreicht die Produktkonzentration nach kurzer Zeit jeweils ein Maximum, um danach durch Hydrolyse des gebildeten Gl-7-ACA 18 rasch wieder abzunehmen. In Gegenwart von 13.2 Äquivalenten Acyldonor 264 erreicht die Produktkonzentration sehr schnell ihren Maximalwert von circa 20%, verbleibt aber dann längere Zeit auf diesem Niveau. Die scheinbare weitere Zunahme bei längeren Reaktionszeiten beruht auf einer Abnahme der 7-ACA-Konzentration durch Hydrolyse zu Deacetyl- 7-ACA (389) (HACA). O O H2N S O O GA HO NH S + N OAc HO NH2 O N OAc 264 CO2H O 17 CO H 2 Gl-7-ACA 18 GA OH- H2N S O O N OH HO OH O 25 CO H 2 HACA 389 Abb. 127. Synthese von Gl-7-ACA in wäßrigen Medien Die ausbleibende Abnahme der Gl-7-ACA-Konzentration könnte – neben einer sich kompensierenden Synthese/Hydrolyse-Situation auf Produktinhibition zurückzuführen sein. Letztere resultiert aus der fortschreitenden Hydrolyse von Glutarsäuremonoamid (264) zu Glutarsäure (25), deren zunehmende Konzentration für eine Blockierung der Glutarylbindetasche des Enzyms sorgt. Die Ausgangskonzentrationen der Edukte betrugen 58 mmol/L für 7-ACA, sowie 153 mmol/L, 458 mmol/L und 763 mmol/L für Glutarsäuremonoamid. III.2.6. Zusammenfassende Betrachtung Umsatz und Selektivität von GA-katalysierten Reaktionen konnten mit einer Reihe unterschiedlicher Analysemethoden bestimmt werden, wobei eine Fokussierung auf kernresonanzspektroskopische und HPLC-Methoden nahe lag. Die Etablierung eines azokupplungsbasierten Aktivitätsassays war aufgrund verschiedener Faktoren wenig erfolgreich. Ein Vergleich der unabhängig voneinander angewendeten Methoden untereinander zeigt eine gute Korrelation der erhaltenen Ergebnisse, so etwa bei der Umsatzbestimmung der Hydrolyse von N- Acyl-p-nitroaniliden parallel mittels UV/vis-Spektrometrie und HPLC oder der Ermittlung der Enantioselektivität der Hydrolyse von 168, 283 und 239 parallel mittels Kernresonanzspektroskopie 131 III.Allgemeiner Teil und HPLC. Die für Umsatz- und Selektivitätsbestimmung entwickelten HPLC-Methoden vereinfachen und verkürzen die Analysen im Vergleich zu literaturbekannten Methoden und sind zudem flexibel in ihrer Übertragung auf zukünftige analytische Herausforderungen. (-)-Chinin wurde erstmalig erfolgreich zur Ermittlung von Enantiomerenverhältnissen von Aminosäurederivaten eingesetzt. Bei der Hydrolyse von chiralen Glutarylamiden zeigt die GA eine Enantiopräferenz für die, auf die Substituentengröße bezogene, (R)-Konfiguration. Das Reaktionsmedium hat erheblichen Einfluß auf das Ausmaß der Enantiodifferenzierung, ebenso wie die Präsenz von α-ständigen Oxyfunktionalitäten. Am Beispiel des Phenylglycinols wurde eine präparative kinetische Racematspaltung durchgeführt und (S)-Phenylglycinol mit 94% ee erhalten. In weiteren Experimenten konnte gezeigt werden, daß die GA in polaren aprotischen Lösungsmitteln mittels Acyltransfer Gl-7-ACA 18 synthetisiert, und auch in Wasser ein kinetisch kontrollierter enzymatischer Acyltransfer durch die GA erfolgt. 132 III.Allgemeiner Teil III.3. Vergleich der Glutaryl-Acylasen verschiedener Hersteller Enzyme identischer E.C.-Klassifizierung stammen oftmals aus unterschiedlichen Ursprungsorganismen und weisen daher meist eine unterschiedliche Aktivität und Selektivität bei der Umsetzung des gleichen Substrats auf. Unter Anderem wurde dies auch am Beispiel der Penicillin G-Acylasen aus E. coli und Alcaligenes faecalis experimentell demonstriert [46]. Die ermittelten Daten wiederum wurden im Rahmen eines Homologiemodellings berücksichtigt, welches illustrierte, daß trotz großer Übereinstimmungen in Sequenz und Struktur der Austausch weniger Aminosäuren zu stark veränderten Eigenschaften führen kann [31]. Wegen der strukturellen Verwandschaft von PGA und GA ist eine ähnliche Tendenz prinzipiell auch für solche Glutaryl-Acylasen zu erwarten, die von unterschiedlichen Herstellern in der biotechnologischen Produktion von 7-ACA verwendet werden. Als eine Kooperation mit Prof. Dr. S. Riva am ICRM Milano konnten im Rahmen dieser Dissertation vergleichende Untersuchungen mit den von Recordati und von Roche produzierten Glutaryl-Acylasen durchgeführt werden. Diese befaßten sich vor allem mit der Ermittlung der Anfangshydrolysegeschwindigkeiten für eine Reihe verschiedener Substrattypen. Beide Enzyme werden durch Fermentation aus rekombinanten Stämmen von E. coli gewonnen, wobei allerdings der Ursprungsorganismus des jeweils für die GA codierenden Gens von den Herstellern leider nicht offengelegt wurde. Eine Gelelektrophorese zeigt, daß beide Enzyme αβ- Heterodimere mit praktisch identischen Molekulargewichten sind. Abb. 128. SDS-PAGE der Glutaryl-Acylasen 133 III.Allgemeiner Teil III.3.1. Bestimmung der Anfangshydrolysegeschwindigkeit verschiedener Substrate Die Ermittlung der Anfangshydrolysegeschwindigkeit erfolgt durch Titration der durch die GA freigesetzten Glutarsäure. Da die enzymatische Hydrolyse der Michaelis-Menten-Kinetik folgt, erlaubt die festgestellte Hydrolyserate eine quantitative Aussage über die Qualität des Substrats. Hierzu wurde eine 50 mM wäßrige Lösung des Substrats bei pH 8.0 mit der GA versetzt und der Verbrauch an Titrationsmedium zur Aufrechterhaltung des pH-Werts über einen Zeitraum von 10 oder 20 Minuten bestimmt [74]. Die erhaltene Hydrolyserate wurde in Relation gesetzt zu der Hydrolyserate, die aus dem Verbrauch an Titrationsmedium bei der Hydrolyse von Gl-7-ACA 18 ermittelt wurde. Aufgrund der erheblichen Auswirkung von Umwelteinflüssen auf die Titration war eine Kalibration durch Umsetzung von Gl-7-ACA 18 zu Beginn und Ende jeden eines Meßtages auszuführen. III.3.1.1. Hydrolyserate verschiedener N-Acyl-7-aminocephalosporansäurederivate Bei der Hydrolyse von im Acylteil verschieden substituierten Gl-7-ACA-Derivaten zeigten sich mit einer Ausnahme nur relativ geringe Unterschiede zwischen den beiden Enzymen. Das Diglykolyl- Derivat 310 wurde von der Recordati-GA wesentlich langsamer hydrolysiert als durch die Roche- GA. Da das homologe Thiodiglykolyl-Derivat 309 von beiden Enzymen mit nahezu der gleichen Geschwindigkeit umgesetzt wird wie Gl-7-ACA 18, muß die verminderte Reaktionsgeschwindigkeit auf den sehr polaren Sauerstoff in Position 3 der Acylkomponente zurückgeführt werden, der in der Glutarylbindetasche der Recordati-GA offenbar stärkere repulsive Wechselwirkungen erfährt. Tendenziell setzt die Roche-GA die verschiedenen N-Acyl-ACAs etwas schneller um. Dies deutet auf einen geringfügig größeren Durchmesser der Glutaryl-Bindetasche und damit verminderte sterische (im Fall des Diglykolyl-Derivats 310 zusätzlich hydrophobe) Restriktionen hin. Tab. 51. Relative Hydrolyseraten verschiedener N-Acyl-7-ACA-Derivate Substrat rel. Hydrolyserate [%] Substrat rel. Hydrolyserate [%] GA Recordati GA Roche GA Recordati GA Roche HO O HN S 7.1 26.7 HO HN S 26.5 29.3 O O N OAc O Cl O N OAc O O COOH COOH 310 311 HO S HN S 95.6 95.5 HO HN S 19.1 20.2 O O N OAc O O N OAc O O COOH COOH 309 308 134 III.Allgemeiner Teil III.3.1.2. Hydrolyserate enantiomerenreiner N-Glutaryl-amide Die Hydrolyse einiger enantiomerenreiner N-Glutaryl-amide zeigt eine deutliche Präferenz beider Enzyme für die (R)-Konfiguration bezüglich der Größe der Substituenten am stereogenen Zentrum. Zudem resultiert aus dem Vergleich der Hydrolysegeschwindigkeiten für ein Enantiomerenpaar ein Hinweis auf die Enantioselektivität der beiden betrachteten Glutaryl-Acylasen. Die Recordati-GA weist gegenüber der Roche-GA eine verringerte Aktivität bei der Hydrolyse der (auf die Substituentengröße bezogenen) (S)-konfigurierten Glutarylamide auf und sollte damit bei einer kinetischen Racematspaltung deutlich bessere Enantiomerenüberschüsse liefern. Tab. 52. Relative Hydrolyseraten enantiomerenreiner Glutarylamide Substrat rel. Hydrolyserate [%] Substrat rel. Hydrolyserate [%] GA Recordati GA Roche GA Recordati GA Roche NHGl 1.0 6.3 NHGl 81.7 81.4 CO2Me CO2Me (R)-283 (S)-283 NHGl 6.1 8.7 NHGl 11.8 9.8 169 170 NHGl 3.9 9.5 NHGl 7.0 10.2 183 184 III.3.1.3. Hydrolyserate racemischer N-Glutaryl-arylglycinmethylester Die Glutaryl-Derivate von Arylglycinmethylestern wie 285 und 286 stellen eine Gruppe von Substraten dar, welche von beiden Glutaryl-Acylasen mit hoher Geschwindigkeit umgesetzt werden. Hierbei zeigte sich die Recordati-GA etwas aktiver als das von Roche produzierte Enzym. Tab. 53. Relative Hydrolyseraten von N-Glutaryl-arylglycinen Substrat rel. Hydrolyserate [%] Substrat rel. Hydrolyserate [%] GA Recordati GA Roche GA Recordati GA Roche NHGl 77.0 65.9 55.1 47.3 CO2Me CO2Me S NHGl HO 286 285 III.3.1.4. Hydrolyserate racemischer N-Glutaryl-β-arylalaninderivate Untersuchungen der enzymatischen Hydrolyse von α-Aminosäurederivaten durch die Glutaryl- 135
Description: