Atlas Tematico De Quimica PDF
Preview Atlas Tematico De Quimica
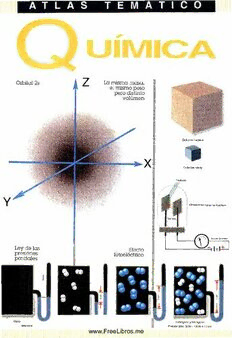
www.FreeLibros.me Q U ÍM IC A IDEA BOOKS, S.A. www.FreeLibros.me Título de la colección ATLAS TEMÁTICOS Texto e ilustración ©1996 IDEA BOOKS, S.A. Redacción / M.a Ángeles Febrer Canals, Doctora en Ciencias Químicas Ilustraciones / Montserrat Fabra Hernández, José M.a Thomas-Doménech Diseño de la cubierta / Lluís Lladó Teixldó Prlnted in Spaln by Emegé, Industria Gráfica, Barcelona EDICIÓN 1997 www.FreeLibros.me P R Ó L O G O La Química es una ciencia: estudia la constitución y el comporta miento de las sustancias materiales, cómo se transforman unas en otras, y también la manera como utilizarlas; explica e interpreta transformaciones materiales y es capaz de predecir otras nuevas. Esta definición es a la vez restringida y amplia, pues todas las cien cias están relacionadas y conexionadas. Así, la Química necesita de las Matemáticas para sus cálculos, la determinación de sus medidas y el establecimiento de sus leyes; muchos de sus méto dos y los conocimientos acerca del átomo se basan en la Física; a su vez, la Química contribuye al desarrollo de otras ciencias y téc nicas: Biología, Geología, Ingeniería, Astronáutica, etc. Para conocer una sustancia material es necesario saber cuál es su composición -calidad y cantidad de sus componentes-, el modo de unión de sus partículas fundamentales constitutivas y la distri bución espacial de las mismas. No se conoce bien una molécula o agregado de átomos, ni un cristal iónico o agregado de iones, si no se sabe cómo es su estructura, o sea cómo están distribuidos sus átomos o sus iones en el espacio; para el conocimiento de los áto mos se precisa averiguar su estructura electrónica; para conocer una reacción, transformación de unas sustancias en otras, se pre cisa saber cómo ocurre este cambio estéricamente. Por tanto, y esto es importante, hay que «ver» los elementos y los compuestos en el espacio y «pensar» la Química tridimensionalmente; puesto que las representaciones en el papel son planas, es conveniente la utilización y el manejo de modelos atómicos. La Química, como todas las ramas del saber, ha ¡do evolucionando con el tiempo, entre tanteos, equivocaciones y certezas. De modo que explicaciones de fenómenos y teorías válidas en otras épocas pueden en la actualidad continuar siéndolo, o, al revés, ser incom pletas o inadecuadas. Análogamente, teorías que en el presente se tienen por válidas son susceptibles, en un futuro próximo o lejano, de modificarse, completarse, ampliarse o ratificarse. Las numerosas publicaciones que continuamente aparecen -libros, monografías y revistas- desbordan al químico y le hacen prohibitivo abarcar no ya toda la Química, sino incluso toda una rama de esta ciencia, como la Química Inorgánica, Química Ana lítica, Química Orgánica, Química Técnica, etc. Este ATLAS pre tende dar los conceptos fundamentales generales de la Química actual. Deseo expresar mi más cordial agradecimiento a José MU Tho- mas-Doménech, que ha realizado los dibujos de este ATLAS, innovadores en su género; a Montserrat Fabra Hernández, que lo ha secundado eficazmente con su colaboración, y a los compa ñeros que me han ayudado con sus sugerencias y comentarios. LA AUTORA www.FreeLibros.me Sustancias químicas MATERIA ) dos de medición corrientes, y en la práctica se continúa aplicando y utilizando la ley de la Cualquiera de los objetos que nos rodea es una conservación de la masa: «La masa no se crea sustancia química o una cierta clase de materia, ni se destruye, sólo se transforma». la cual implica masa. Es imposible dar una defi Ley de las proporciones definidas. — De Proust nición de MATERIA. En principio puede decirse ) (1754-1826). Llamada también ley de las pro que ocupa lugar, o sea tiene volumen; en el porciones constantes y ley de las proporciones vacío no hay materia, pero se maneja y se des : fijas (fig.2): Dos o más elementos que se com criben sus propiedades. La MASA, según la ecua binan para formar un compuesto, lo hacen ción fundamental de la dinámica clásica, provie siempre en una relación de su masa constante. ne de la relación entre la fuerza aplicada a un Si 71,0 g de cloro se combinan con 16 g de oxí cuerpo y la aceleración que le comunica. MATE geno para formar 87 g de óxido de dicloro, RIA Y MASA no son sinónimos, pero de hecho, Cl20, 17,7 g de cloro se combinarán con 4,0 g cantidad de materia y masa son indeslindables, de oxígeno para formar 21,7 g de C120, y 142 pues aumentan y disminuyen conjuntamente y g de cloro se combinarán con 32 g de oxígeno se miden de la misma manera. Las ciases de para formar 174 g de Cl20. Por tanto, si una materia o sustancias químicas son enormemente cantidad de un elemento se trata con exceso de variadas. Los barrotes de un balcón son de hie otro, este exceso no reacciona. rro, un metal; el mercurio de un termómetro es Ley de las proporciones múltiples. — De Dalton otro metal; el tubo que lo contiene es de vidrio; (1766-1844). Diferentes cantidades de un mismo el papel y el algodón son de celulosa. elemento que se combinan con una cantidad fija Las sustancias constituidas por una sola clase de otro elemento, para formar diversos compues de materia son los CUERPOS SIMPLES o ELE tos, están en la relación de números enteros y MENTOS QUÍMICOS; actualmente se conocen sencillos (fig. 3). El azufre forma dos óxidos 109. Las partículas fundamentales de cada ele importantes: el dióxido de azufre, S02, y el trió mento son los ÁTOMOS QUÍMICOS. Las sus xido de azufre, S03; las diferentes cantidades de tancias formadas por la unión de dos o más ele oxígeno que se combinan con una misma canti mentos son los COMPUESTOS QUÍMICOS; se dad de azufre están en la relación 2 : 3. El estaño conocen más de tres millones y continuamente forma dos cloruros: el dicloruro de estaño, SnCl2, se descubren otros nuevos; este elevado núme y el tetracloruro de estaño, SnCI4; la relación de ro es debido a la facultad de unirse diferentes las diferentes cantidades de cloro combinadas elementos y de diferentes maneras. Las partícu con una misma cantidad de estaño es 2 : 4, o 1 : las fundamentales de cada compuesto (la 2. Cada compuesto de éstos, prescindiendo del mayoría de las veces) son las MOLÉCULAS. otro, sigue la ley de las proporciones definidas; así, al aplicar ésta al dicloruro de estaño, la rela LEYES PONDERALES ción de estaño combinada con cloro es: Ley de la conservación de la masa. — De Lavoi- Sn _ 118,70 g estaño 59,35 g Sn sier (1743-1794). En las transformaciones quí 2 Cl “ 2 ■ 35,5 g cloro “ 35,5 g Cl ' micas corrientes, la suma de las masas de las sustancias reaccionantes es igual a la suma de y en el SnCI4 la relación como están combina las masas de las sustancias resultantes (fig, 1). dos sus elementos es: Así, al quemar 12 g de carbono con 32 g de oxí Sn _ 118,70 g estaño 29,7 g Sn geno se forman 44 g de dióxido de carbono. 4 Cl “ 4 - 35,5 g cloro ~ 35,5 g Cl Para los fenómenos nucleares, en los que apare ce energía a expensas de un defecto de masa, Ley de las proporciones recíprocas. — De Rich- rige la ecuación de Einstein: E = m-c2, donde ter 0 762-1807). La relación entre distintas can m = masa, c = velocidad de la luz = 2,998-108 m/s, tidades de diferentes elementos combinadas con o seac2 = 9-1016 (m/s)2, E = energía liberada al una cantidad fija de otro elemento, es la misma desaparecer la masa m. Considerando la masa relación con que se combinan entre sí (fig. 4). El como una forma de energía, las leyes clásicas carbono se combina con el hidrógeno para for de la conservación de la masa y de conserva mar el metano, CH4, y con el cloro para formar ción de la energía se reúnen en una sola. En los el tetracloruro de carbono, CCI4; la relación con procesos químicos también hay interconversión que el hidrógeno y el cloro se combinan con entre masa y energía, pero la variación de masa una misma cantidad de carbono es: es tan ínfima que no es apreciable por los méto- (Continúa en la lám. A/4) ATLAS DE QUÍMICA 6 www.FreeLibros.me Leu es n / 1 ponderales n a ° » a 0 a Oq O 'q a » » ' • & $ ® 8 Ü®. ^9 ( í o J Jq ® O © 15 átomos de carbono + 20 átomos de oxígeno —> 10 moléculas de dióxido de carbono. Sobran 5 átomos de carbono Con múltiplos muy grandes de las masas atómicas, los átomos-gramo serian: 180 g de carbono + 320 g de oxígeno = 440 g de dióxido de carbono. Sobran 60 g de carbono Fig.l — Ley de la rnncprv:,ri|^n 4o la maca Q + ° _ Q'j> 1a záutofrmeo de + 2o xáígtoemnoo s de * 1d om doelé cauzulaf rdee dióxi Q 1 S 32,064 g S __ 8,016 g S 1 s s o. 20 2 -15,999 g O 8,000 g O o Q 1 átomo de 3 átomos de í molécula de trióxi azufre + oxígeno do de azufre Q — * í¿ T T 5 32,064 g S _ 5,344 g S 3 0 3-15,999 g 0 8.000 g 0 1 s 30 ' ( • Fig. 2 - Ley de las proporciones definidas. Relación de las diferentes cantidades de oxigeno 2 13,999 g _ £ combinadas con una misma cantidad de azufre: 3 15,999 g 3 EQUIVALENTE del azufre en el SO? ; 8,016 g EQUIVALENTE del ozufre en el SO-, ; 5,344 g Fig. 3 - Ley de las proporciones múltiples. H I I H - - © r 1 © r ° i o H ci 4H __ 4 1,008 9 H 4CI _ 4 35,45 g Cl 1,008 g H ,H — 1C 12,011 gC ' 1C 12,011 g C Relación de las cantidades de 1CI ” 35,45g Cl 4H _ 4 1,008 g H _ JH_ hidrógeno y de cloro combina Relación de las cantidades de das -con una misma cantidad hidrógeno y de cloro combi- 4CI _ 4 35,45 g C1 1CI de carbono. nadas entresi. Fig. 4 - Ley de las proporciones recíprocas. SUSTANCIAS QUÍMICAS: MATERIA 7 www.FreeLibros.me Sustancias químicas Equivalente químico. — Ya que los elementos masa molecular, o la masa atómica, es decir, la son pocos y los compuestos muchísimos, en los masa formular en daltons. inicios de la Química se pensó en una cantidad de elemento que sirviera de referencia para DENSIDAD todos. De aquí vino el concepto de equivalente químico que se describió como la cantidad de La densidad absoluta de una clase de materia es la masa de la unidad de volumen. Se mide en uni sustancia que puede combinarse con 8,000 g de dades de masa dividido por unidad de volumen. oxígeno, o sustituir 8,000 g de oxígeno. El equi valente químico depende exclusivamente del Si la masa se mide en gramos o en kilogramos y el volumen en cm3 o en m3, la densidad se expre compuesto concreto. Así, en el S02 el equiva sa en g/cm3 o en kg/m3 respectivamente. Así, la lente químico del azufre es 8,016 g, pues está densidad del agua es 1 g/cm3 = 1.000 kg/m3 sig combinado con 8,000 g de oxígeno; y en el S03 el equivalente del S es 5,344 g, o sea la cantidad nifica que 1 cm3 de agua tiene la masa de 1 g o 1 m3 tiene la masa de 1.000 kg. La densidad del combinada con 8,000 g de oxígeno (lám. A/1, mercurio es 13,6 g/cm3, significa que 13,6 g de fig. 3.). Por la ley de las proporciones defindas, la mercurio ocupan el volumen de 1 cm3. La densi relación con que se combinan los elementos es dad del éter es 0,78 g/cm3 = 780 kg/m3, significa la relación de sus equivalentes químicos. Por la que 0,78 g de éter ocupan el volumen de 1 cm3 ley de las proporciones múltiples, un mismo ele 0 que 1 m3 de éter tiene la masa de 780 kg. La mento puede tener varios equivalentes. densidad absoluta de un gas se suele expresar en MOL g/dm3, y así la densidad absoluta del oxígeno en condiciones normales es de 1,43 g/dm3. Cada sustancia química, o sea cada clase de materia, con aspecto continuo, es en realidad PRESIÓN discontinua pues proviene de la agrupación de multitud de diminutas partículas de las que-aun Presión es la fuerza ejercida sobre la unidad de que descomponibles en otras todavía menores- superficie. Se mide en unidades de fuerza o peso se consideran sus entidades fundamentales o ele dividido por unidades de superficie. Usualmente mentales, llamadas así porque son las más se toma como unidad de presión el peso de una pequeñas partículas que conservan las caracterís columna de mercurio de 760 mm de altura y ticas de cada clase de materia (que no sean las 1 cm2 de base; se dice que es la presión de 1 estadísticas), es decir todavía son esa sustancia. atmósfera o 760 torr. En el sistema internacional En Química, la unidad empleada para medir una de unidades, SI, la unidad de presión es la fuerza cantidad de clase de materia es el mol. El MOL del 1 N ejercida sobre 1 m2, y se denomina Ras- se define como la cantidad de sustancia que con cal, Pa; 1 atmósfera = 760 torr = 1,013 • 105 Pa. tiene un número de sus entidades fundamentales En talleres y en los tubos de gases expresan la pre igual al número de átomos que hay en 0,012 kg sión en kilopondios/cm2 (kgtm2 no es correcto); de carbono-12. Este número se denomina cons la equivalencia es 1 atm = 1,033 kp/cm2. Una tante de Avogadro, que se simboliza por NA y misma fuerza puede ejercer distintas presiones equivale a NA = 6,022045 • 1023 entidades/mol. según la superficie sobre la cual se aplique; un Al usar el mol hay que especificar las entidades cubo de hierro de 5 cm de arista que pesa 9,63 N fundamentales, que pueden ser: átomos, iones, o sea aproximadamente 1 kp, se hunde en nieve moléculas, electrones, fotones... o grupos espe blanda, pero no ocurre lo mismo con una plancha cificados de tales partículas. delgada de hierro del mismo peso; un clavo pene Masa formular. — Es la masa de la entidad fun tra en la pared por la punta porque su superficie damental. Se suele medir en daltons, d (ver B/1), es mínima, pero aplicando la misma fuerza no y resulta de la suma de las masas de sus átomos penetra por la cabeza porque su superficie es o sus iones constituyentes. Si la entidad elemen mayor, o sea la presión es menor; el fundamento tal es la molécula, la masa formular será la MASA de la prensa hidráulica es que, aplicando peque MOLECULAR; así, la masa molecular del agua es ñas fuerzas, se puede ejercer grandes fuerzas, por 18,016 dalton, pues es la suma de la masa de dos que variando la superficie la presión es la misma. átomos de hidrógeno y uno de oxígeno, o sea (2 Es de todos conocido que la materia en la tierra X 1,008 + 16,00) dalton. Si la entidad elemental se presenta en tres estados: sólido, líquido, ga es el átomo, la masa formular es la masa atómi seoso. El que una materia se halle en un estado u ca, siendo la del cobre de 63,54 daltons. otro depende de ciertas condiciones, como pre Masa molar. — Es la masa de 1 mol de sustancia. sión, temperatura, etc. Una clase de materia en Así, la masa molar del agua es 18,016 g y la del determinadas condiciones posee unas propieda cobre 63,54 g. El número que expresa la masa des características, como densidad, dureza, molecular en gramos es el número que expresa la color, conductividad eléctrica, viscosidad, etc. ATLAS DE QUÍMICA 8 www.FreeLibros.me Densidad. 0 / p Leqes de los gases H ' d Fig. 1 - La misma masa, el mismo peso, pero distinto volumen. m u i P2 = 3P, P, = P, — Vfa P, = V6 P, V3 =VjV, V, = V, + V6 V, = 7/6 P, Fig. 2 - Ley de Boyle: para una misma masa de gas y a temperatura constante, los volúmenes son inversamente poporcionales a las presiones. w ft t w Nitrógeno Hidrógeno y Nitrógeno Presión: 12 cm Presión total:.5 cm +12 cm = 17 Fig. 3 - Ley de las presiones parciales. El l^t pasa menos (hay más HJ Fig. 4 - Difusión de los gases. SUSTANCIAS QUÍMICAS: MATERIA 9 www.FreeLibros.me Sustancias químicas LEYES DE LOS GASES ) toma como 0° la temperatura de una mezcla de agua líquida y hielo, y como 100° la tempera Ley de Boyle. — Permaneciendo constante la tura de una mezcla de agua líquida y vapor de temperatura, los volúmenes que ocupa una , agua. La escala entre 0° y 100° se divide en misma masa de gas son inversamente propor cien partes iguales; cada parte es 1° centígrado cionales a las presiones que ejerce: p, • v1 = p2 • /' (fig. 5). Una comparación entre calor y tempe- v2 = p3 • v3 = ... = v = constante (lám A/2, fig. \ ratura la tenemos en los depósitos A y B 2). La presión de los gases se debe a los choques (fig. 1), en los cuales diferentes cantidades de de sus moléculas contra las paredes del reci líquidos alcanzan un mismo nivel, y en los piente; cuanto mayor sea el recipiente, menor depósitos B y C, donde una misma cantidad de será el número de choque, disminuyendo pro , líquido llega a distinta altura. Sean dos bolas de porcionalmente la presión. hierro (fig. 2), una de 5 g y otra de 15 g, ini- Mezclas de gases. Leyes de las presiones par : cialmente las dos a 20°. Si a cada una le comu ciales de Dalton. — 1) En una mezcla de gases, nicamos la misma cantidad de calor, por ejem la presión ejercida por un gas es la misma que plo unas 430 calorías (exactamente 428 cal), la ejercería si estuviera sólo ocupando el mismo de menor masa llegará a 100° y la de mayor volumen a la misma temperatura. 2) La presión masa, sólo a 46,6° = 47°; con una misma can total de los gases es la suma de las presiones tidad de calor se alcanzan diferentes tempera parciales de cada gas en particular (lám A/2, turas. Si las dos bolas inicialmente a 20° han de fig. 3). Esto es así porque la presión se debe al aumentar 10°, o sea llegar a 30°, a la pequeña, número de choques de las moléculas contra las de masa 5 g, se le han de comunicar 5,35 calo- paredes, y depende del número de moléculas, ) rías, y a la mayor, de masa 15 g, se le han de no de la especie de éstas. dar 16,05 calorías; con distinta energía calorífi- Difusión de gases. Ley de Graham. — Las velo j ca se alcanza la misma temperatura. cidades de difusión de los gases (lámina A/2, Calor específico. — Es la cantidad de calor que fig. 4) son inversamente proporcionales a las se ha de comunicar a 1 g de una sustancia para raíces cuadradas de sus densidades: elevar 10 su temperatura. El calor específico del Velocidad del gas A _ v Densidad del gas B hierro es 0,107 cal/0 g; significa que para elevar Velocidad del gas B V Densidad del gas A 1° la temperatura de 1 g de hierro se necesitan 0,107 calorías. La caloría es el calor específico del agua; es decir, para elevar 1° la temperatu CALOR Y TEMPERATURA ra de 1 g de agua se necesita 1 caloría. Calor. — Es una de las varias formas de energía. Leyes de los gases. - Leyes de Charles-Gay Lus- La energía, capacidad de realizar trabajo, se sac. — 1. A presión constante (lámina A/3, fig. manifiesta de distintas maneras: mecánica o tra 4, p. sup.), los volúmenes ocupados por una bajo, calorífica, eléctrica, luminosa, química, misma masa de gas son directamente propor etcétera. Las diferentes formas de energía se pue cionales a las temperaturas absolutas: den transformar unas en otras; es decir, puede \ V, V-, V, V aplicarse a los sistemas macrocópicos la ley clá- — i- = —— = —— = ...= — = constante. sica:«La energía no se crea ni se destruye, sólo se Ti T2 T3 T transforma». Cuando un gas se expansiona, rea Por cada grado que se aumente la temperatura liza un trabajo a expensas de la energía calorífi- / de un gas, éste se dilata 1/273 de su volumen ca que se le suministra exteriormente; en las inicial; si el volumen inicial es II, después de centrales eléctricas se aprovecha la energía aumentar 1 ° su temperatura, el volumen será 11 mecánica de un salto de agua para transformar + l/27¡ I; si se eleva 2°, el aumento de volumen la en eléctrica, y ésta se transforma en mecánica será 2/27¡ 1 y el volumen final 11 +2/27¡ I; en al hacer trabajar una máquina; en las resisten general, si la temperatura de un volumen inicial cias eléctricas hay transformación de energía v¡ de un gas se eleva t°, el volumen final será Vf eléctrica en calor; el trabajo de rozamiento de + v¡ • t/273°. Asimismo, si se disminuye la tem dos cuerpos siempre produce calor. peratura, la disminución de volumen es 1/273 (o Como consecuencia, cualquiera de las formas de sea el aumento - 1/273) por grado y por unidad energía se podrá expresar en cualquier unidad de de volumen; si I litro de un gas a 0 "C descen energía; así, el calor se expresa en unidades de diera 273°, la disminución de volumen sería calor, o calorías, y en unidades de trabajo, por 273/27) y el volumen final 1 - 273/27J = 0, lle ejemplo jouls o julios; y el trabajo se expresa en gando a un volumen nulo, o sea al imposible unidades de trabajo y también de calor. de que una cantidad de materia no ocupara Temperatura. — La temperatura nos da el nivel volumen (en el supuesto de que continuara en térmico de un cuerpo. Se mide en grados; se estado gaseoso). Esta temperatura, - 273°, Ha- ATLAS DE QUÍMICA www.FreeLibros.me 10 Calor g temperatura. □ , n Lepes de los gases Fig. 1 - A y B: distinta cantidad de líquido, el mismo nivel. - B y C: la misma I A cantidad de líquido, distinto nivel. jarro con 100 mi de agua +5,35 calorías. Con distinta cantidad de calor, el aumento de temperatura es el +16,05 calorías mismo At = 10° Temp. final: 30° +430 caloríasv Con igual cantidad de a cada una calor, la temperatura Dos bolas de hierro final es distinta. Estado inicial: 20° Olla con 20 litros de agua Inicialmente los dos a temperatura del ambiente. Fig. 3 - Para que hierva el jarro, basta una pequeña Fig. 2 - Relaciones entre masa, cantidad de calor y temperatura. llama. Para la olla se necesita un fogón, pues con la pequeña llama apenas se calienta. _2Vj_ 2T, 100° 373° Mezcla de agua La masa del gas no varía líquida y vapor (agua hirviente): punto de ebyJli- V3 ’/fVi T " v3t, El numero de choques de las moléculas es el mismo p2 V.T, Ti v3t, IJ 273° Mezcla de agua v\ La masa del gas no varía líquida y hielo: punto de fusión. 2'A 2AT, El número de choques varía con la presión Fig. 4 - Arriba: a presión constante, V es directamente proporcional a T. Fig. 5 - Graduación de un termómetro centígrado. Abajo: a volumen constante, P es directamente proporcional a T. SUSTANCIAS QUÍMICAS: MwAwTEwRI.AF rYe EeNLEibRrGoÍAs.me 11
